Penurunan Titik Beku Larutan dan Contoh Soal
faktasantuy.com - Penurunan titik beku larutan.
Sahabat, pada peluang ini kami bakal mengulas materi kimia Penurunan Titik Beku Larutan yang sebelumnya kami mengulas penurunan tekanan uap larutan. Penurunan titik beku larutan merupakan materi yang dipelajari di kelas XII IPA yang menurut saya pelajarannya tidak terlalu sulit untuk dipelajari.
Nah, apa saja pengertian titik beku? rumus tikik bake baru
PENURUNAN TITIK BEKU LARUTAN
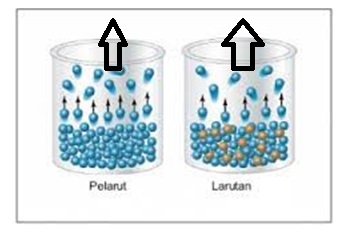
Perisitiwa perubahan bentuk sebuah zat dari cair ke padat disebut membeku, jadi, pengertian titik beku ialah suhu pada ketika zat cair mulai membeku.Air murni mempunyai titik beku 0˚C. Apabila di dalam air dilarutkan sejumlah zat terlarut yang sukar menguap, umpama gula sampai seluruh gula larut sempurna & terbentuk larutan lalu didinginkan. Berapa titik beku larutan gula tersebut? Nyatanya larutan tersebut bakal membeku pada suhu dibawah 0˚C.
Suhu pada ketika air murni sebagai pelarut mulai membeku (0˚C) disebut titik beku pelarut, berikut rumus penurunan titik beku: (∆Tf = T˚f – Tf) & pada ketika larutan gula mulai membeku disebut titik beku larutan (Tf), sedangkan selisih antara titik beku pelarut dengan titik beku larutan disebut penurunan titik beku larutan (∆Tf). Dengan cara matematis bisa ditulis:
∆Tf = T˚f – Tf
Suatu larutan non elektrolit 0,1 m dengan air murni sebagai pelarut bakal membeku pada suhu -0,186?C, untuk konsentrasi 0,2 m larutan bakal membeku pada suhu -0,372˚C & dengan konsentrasi 0,3 m larutan bakal membeku pada suhu -0,558˚C. Berdasarkan data eksperimrn tersebut, maka sebanyak 1 m larutan nonelektrolit dengan air sebagai pelarut bakal membeku pada suhu -1,86˚C. Pada konsentrasi 1 m penurunan titik beku larutan tersebut sebesar 0?C - (-1,186˚C) = 1,86˚C.
Jadi, bakal terjadi penurunan titik beku sebesar 1,86˚C tiap molal pada larutan nonelektrolit dengan pelarut air. Kualitas 1.86˚C m-1 selanjutnya disebut dengan tetapan penurunan titik beku molal pelarut (air) atau Kf air. Kualitas Kf tergantung dari tipe pelarut yang dipakai.
Melewati data eksperimen diatas bisa dirumuskan hubungan antara penurunan titik beku (∆Tf) dengan kemolalan sebagai berikut:
∆Tf = Kf x m
Keterangan:∆Tf = penurunan titik beku larutan dengan satuan (˚C).
Kf = tetapan penurunan titik beku molal pelarut (˚C m-1).
Nah itulah postingan materi pengertian larutan. Semoga PR materi Kimia tentang penurunan titik beku larutan kamu bisa terlesaikan dengan melihat artikel diatas. Apabila ingin bertanya mengenai penurunan titik beku larutan atau rumus penururan titik beku, silakan ketik di komentar dibawah.
Terima kasih telah membaca postingan kimia tentangtitik beku. Baca Juga:
- 5+ Soal Dan Pembahasan Gelombang Bunyi Beserta Rumusnya
- Intensitas dan Gelombang Bunyi + 9 Soal Jawaban
Bagi sahabat yang ingin copas isi postingan pengertian titik beku larutan ini, maka diinginkan untuk cantumkan sumber dengan "Link Aktif Menuju ke Postingan Ini", apabila tidak dicantumkan, maka blog sahabat bakal saya laporkan ke DMCA.

Posting Komentar untuk "Penurunan Titik Beku Larutan dan Contoh Soal"
Sobat boleh menyalin isi artikel ini dengan syarat ditulis ulang dengan menyertakan link sumber ke artikel ini. Ini berguna supaya blog sobat tidak kena deindex/dihapus karena menerima keluhan hak cipta DMCA dari saya.
Jika artikel ini bermanfaat untuk sekolah/kuliah/pekerjaan sobat, maka berikanlah sedikit donasi untuk membantu admin dalam membiyai operasional blog ini.
Klik: Donasi via Trustwallet